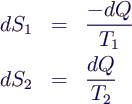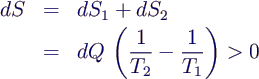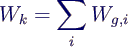Entropie und 2. Hauptsatz
- Änderung der Entropie eines Systems:
- durch Wärmetransport
- dSq := dQ/T (Entropietransport)
- durch Dissipation
- dSi := dWdiss/T ≥ 0
(Entropieerzeugung)
- reversible Prozesse charakterisiert durch dSi
= 0
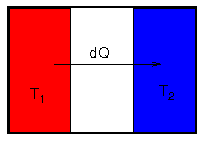
- Beispiel: Entropieerhöhung beim Wärmetransfer
- Wärmemenge dQ > 0 fließe von warmem Körper
zu kaltem Körper
- Entropieänderung der Körper
- Entropieänderung des Gesamtsystems
- Formulierung des 2. Hauptsatzes:
- adiabates System (dQ = 0) → Entropie nimmt nie ab
- bleibt gleich genau für reversible Prozesse
- bei nicht-adiabatischem System: betrachte alle Wärmequellen
als Teil des Systems →
- In einem abgeschlossenen System nimmt die Gesamtentropie
niemals ab. Sie bleibt gleich für reversible Prozesse.
- Auswirkung auf irreversible Kreisprozesse:
- Unterscheidung nötig zwischen Volumenänderungsarbeit WV
des Gases und auf den Kolben abgegebene Arbeit Wg
- Kompression
- WV > 0, Wdiss > 0
- → Wg > WV
- zur Kompression des Gases ist mehr Arbeit am Kolben
nötig
- klar: Reibung muss überwunden werden
- Expansion
- WV < 0, Wdiss > 0
- → |Wg| < |WV|
- bei der Expansion des Gases wird weniger Arbeit an
den Kolben abgegeben
- klar: ein Teil geht als Reibung verloren
- Kreisprozessarbeit = nach außen abgegebene Arbeit, also
- Aufgaben: