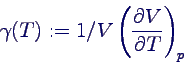Thermische Zustandsgleichung
-
Gesetze von Boyle-Mariotte und Gay-Lussac:
-
bei konstanter Temperatur gilt (Boyle-Mariotte):
-
bei konstantem Druck hat man (Gay-Lussac):
-
Thermische Zustandsgleichung des idealen Gases:
-
bezogen auf Zahl der Teilchen N (folgt aus der statistischen
Mechanik):
-
kB: Boltzmann-Konstante, wichtige Naturkonstante
-
bezogen auf Stoffmenge n (in Mol):
- p V = (N/NA) (NA
kB) T =: n R T
-
R: universelle Gaskonstante, unabhängig von der Stoffart
- R = NA kB = 8.3145
kJ/(kmol K)
-
bezogen auf die Masse m = n M:
- p V = m (R/M) T =: m Ri T
- ⇒ p v = Ri T
- Ri = R/M: spezifische Gaskonstante
-
Molvolumen Vm:
- Volumen eines Mols eines idealen Gases bei
Normalbedingungen p = 1.01325 bar, T = 273.15K
-
beim idealen Gas gegeben durch
- Vm = R T / p = 22.414
m3/kmol
- in Worten: Ein Mol eines idealen Gases unter
Normalbedingungen hat ein Volumen von 22.414 l
-
Volumen-Ausdehnung beim idealen Gas:
-
Ausdehnungskoeffizient γ ist oben definiert worden als
-
mit V = (nR/p) * T:
-
Aufgaben: