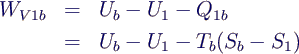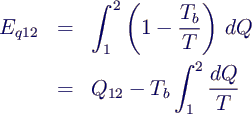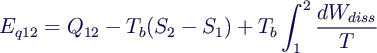Exergie und Anergie
- Beobachtungen:
- Energieformen lassen sich nicht beliebig ineinander
umwandeln
- Umwandlung wird beeinflusst durch Umgebung
- Beispiel Kreisprozess:
- Teil der aufgenommenen Wärme wird wieder
abgegeben
- Wirkungsgrad η hängt ab von Umgebungstemperatur
Tb < Tmin
- η < ηCarnot = 1 -
Tmin / Tmax < 1 - Tb /
Tmax
- Anergie B:
- "unnütze" Energie
- lässt sich (bei vorgegebener Umgebung) nicht in
andere Energieform umwandeln
- Beispiele:
- abzugebende Wärme bei Umgebungstemperatur
Tb
- Druck auf Kolben gleich Umgebungsdruck
- Exergie E:
- "nützliche" Energie
- kann (bei vorgegebener Umgebung) vollständig in
andere Energieformen umgewandelt werden
- Gesamtenergie U = E + B
- Quantifizierung von E und B hängt vom
Umgebungszustand Tb, pb ab
- Formulierung des 2. Hauptsatzes:
- Bei allen natürlichen Prozessen wird Exergie in
Anergie umgewandelt.
- Reversibler Prozess ⇔ Exergie bleibt
konstant
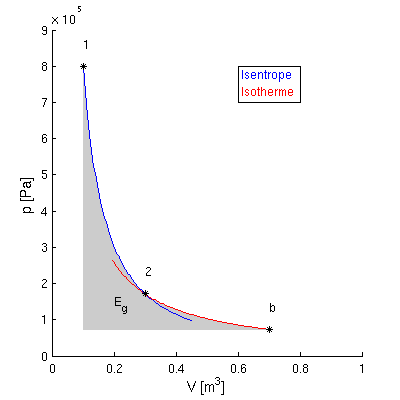
- Exergie beim geschlossenen System:
- Exergie Eg1 = Nutzarbeit der Kolbenstange
bei Übergang von Anfangszustand 1 bis zum Umgebungszustand
- bei Außendruck pb gehört nur Kolbenarbeit
zur Exergie
- Eg1 = -WV1b -
pb (Vb - V1)
- Vb: Volumen des Systems bei
pb, Tb
- Wärmeübertragung nur bei T = Tb, sonst
nicht reversibel
- Prozessführung daher
- zunächst alle innere Energie ausnutzen
(isentrop, bis T = Tb)
- dann reversibel entspannen (isotherm, bis p =
pb)
- Volumenänderungsarbeit nach 1. Hauptsatz
- damit
- Eg1 = U1 - Ub
+ Tb (Sb - S1) - pb
(Vb - V1)
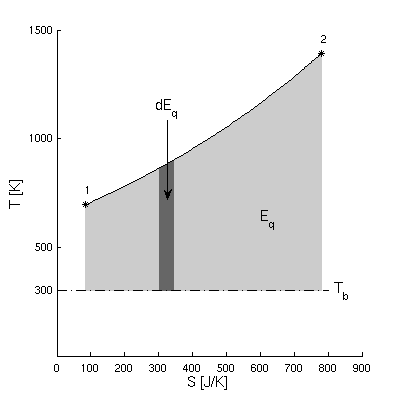
Exergie der Wärme:
- Exergie Eq = Anteil der Wärme, der im
betrachteten Prozess maximal in Arbeit Wk umgewandelt
werden kann
- Prozess 12 in differentielle Teilprozesse zerlegen
- jeweils näherungsweise isotherm
- maximale Arbeit aus der Wärme durch
Carnotprozess zwischen T und Tb
- Exergie eines kleinen Teilprozesses
- dEq = - dWk =
ηC dQ = (1 - Tb/T) dQ
- Integriert:
- mit dQ = T dS - dWdiss ergibt sich
Exergetischer Wirkungsgrad ζ:
- Verhältnis von genutzter zur aufgewandten Exergie
- etwa für Wärmekraftmaschinen
- Vergleich mit η
- η ist beschränkt durch 2. Haupsatz
- theoretische Grenze
- ζ zeigt an, wieviel praktisch erreicht
wurde
- ζ = 1, wenn ηreal =
ηth
Aufgaben: