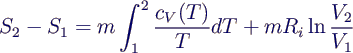Definition der Entropie
- Entropie differentiell:
- für reversible Prozesse gegeben als Wärmeänderung pro Temperatur
- bei nicht-reversiblen Prozessen wird Dissipationswärme
berücksichtigt
- mit 1. Haupsatz:
| dU |
= dQ + dWdiss - p dV |
| |
= T dS - p dV |
| ⇒ dS |
= (dU + p dV)/T |
- Entropie beim idealen Gas:
- kalorische Zustandsgleichung
- thermische Zustandsgleichung
- damit
- dS = m cV dT/T + m Ri dV/V
- lässt sich integrieren zu
- hängt nicht vom Weg, sondern nur von Anfangs- und Endzustand
ab
- für konstantes cV
- S2 - S1 = m cV ln(T2/T1)
+ m Ri ln(V2/V1)
- analog über dH:
- S2 - S1 = m cp ln(T2/T1)
- m Ri ln(p2/p1)
- Grundlegende Eigenschaft der Entropie:
- Entropie ist Zustandsgröße, d.h. hängt nicht vom Prozessverlauf
ab
- gilt grundsätzlich (nicht nur beim idealen Gas)
- Erfahrungstatsache (Ergebnis von Experimenten)
- mathematisch begründbar, aber schwierig