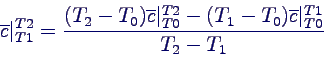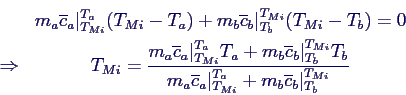Kalorische Zustandsgleichung und Wärmekapazität
-
Kalorische Zustandsgleichung:
- Zustand eines homogenen Systems durch zwei Größen
charakterisiert. Daher können innere Energie und Enthalpie als
Funktionen von z.B. T und p oder T und v angegeben werden. Diese
Beziehungen heißen kalorische Zustandsgleichungen.
-
Zweckmäßige Wahl (vgl. differentielle Energiebilanzen):
-
vollständiges Differential:
-
Spezifische Wärmekapazitäten:
-
partielle Ableitungen nach der Temperatur:
- auf die Masse bezogen (spezifisch)
- i.a. von der Temperatur und vom Volumen bzw. Druck
abhängig
-
cv aus Wärmemessung bei konstantem Volumen bestimmbar:
-
integriert:
-
analog:
-
Spezialfall:
- cV hänge nicht von T ab, keine
Reibung
-
damit
-
in Worten:
- Spezifische Wärmekapazität gibt die benötigte
Wärmemenge an, um 1 kg eines Stoffes um 1 K zu erwärmen.
Geschieht dies bei konstantem Volumen, erhält man
cv, bei konstantem Druck cp.
- cV und cp sind
Stoffeigenschaften, Werte tabelliert
-
Berücksichtigung der Temperaturabhängigkeit in der Praxis:
-
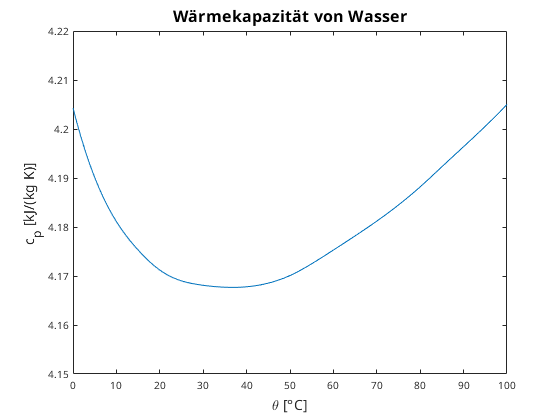
Funktion c(T) in der Regel kompliziert, etwa cp von
Wasser bei Normaldruck (1.01325 bar):
-
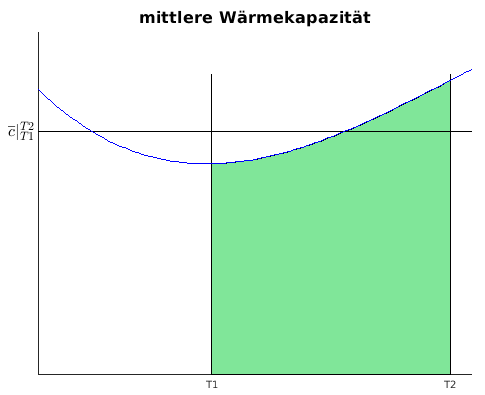
in der Praxis für bestimmte Temperaturbereiche gemittelte Werte:
-
anschaulich: Mittelwert liefert gleiche Fläche
- in Tafeln meist auf feste untere Temperatur
T0 = 0°C bezogen
-
Berechnung von
 aus
Tafelwerten:
aus
Tafelwerten:
-
Temperaturausgleich:
- Mischung zweier Stoffe A, B mit unterschiedlicher
Temperatur → mittlere Temperatur stellt sich ein.
-
Bestimmung der Mischtemperatur aus der Wärmebilanz (adiabatisch):
- Wärme geht vom wärmeren zum kälteren Stoff bis zum
Gleichgewicht.
-
Damit:
-
Problem bei der Temperaturberechnung:
- Wärmekapazität für Bereich bis TMi
benötigt, aber TMi ist nicht bekannt!
- Lösung in der Praxis: Schätzwert für
TMi ergibt Schätzwert für c. Bei nicht zu starker
Temperaturabhängigkeit von c ist die Näherung ok.
- Ist die sich aus dem Schätzwert ergebende
Wärmekapazität sehr verschieden von dem Wert, der sich aus der
berechneten Mischtemperatur ergibt, wiederholt man das Verfahren
mit dem berechneten Wert als neuem Schätzwert.
-
Aufgaben:



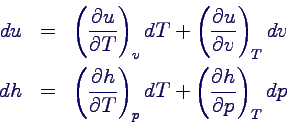

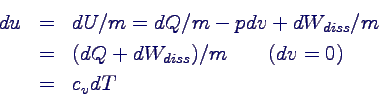

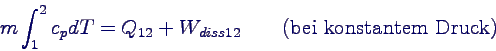
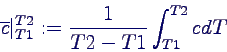
 aus
Tafelwerten:
aus
Tafelwerten: